背景
肝细胞癌 (HCC)是全球第四大癌症相关死亡原因和第五大最常见癌症。每年约有80万人死于该病。约90%的HCC发生在不同严重程度的慢性肝病背景下,诱导纤维化和/或随后的肝硬化。然而,在少于 10%的病例中,肝癌发生在健康肝脏中。肝癌最常见的危险因素是嗜肝病毒感染 (HBV,HCV)、饮酒、黄曲霉毒素B1暴露、血色素沉着和代谢综合征,这在糖尿病和/或肥胖症患者中常见。肝硬化是慢性肝病的终末期,且是西方国家肝癌发展的主要危险因素。
NKG2D系统是通过激活免疫细胞上的受体自然杀伤组2成员D (NKG2D)来识别肿瘤细胞上表达的NKG2D配体,从而在癌症中形成一种强有效的免疫监测机制。本研究中,我们评估了NKG2D配体在人类和小鼠肝癌中的表达,同时考虑了肝癌肿瘤的基因组特征。
简介

2021年1月20日,来自法国巴黎大学的Jean-Pierre COUTY及其团队在J Hepatol (IF: 20.582)杂志上发表名为Expression of NKG2D ligands is downregulated by beta-catenin signaling and associates with HCC aggressiveness的研究[1]。
主要方法
通过Fluidigm TaqMan和RNAseq方法进行分析NKG2D配体 (MICA、MICB、ULBP1和ULBP2)的表达,并在两个小鼠模型 (mRNA和蛋白水平)中再现了两组主要的人类肿瘤的特征。
研究亮点
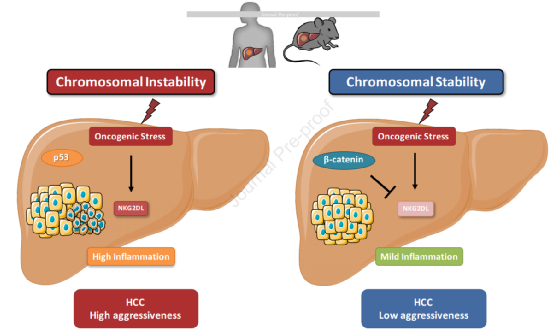
1、MICA和MICB的表达与HCC肿瘤的侵袭性和患者预后差有关。
2、ULBP1和ULBP2的表达与患者不良预后有关,在CTNNB1突变的HCC中下调,与β-连环蛋白 (β-catenin)靶基因表达水平呈负相关。
3、小鼠Rae-1 NKG2D配体在肝细胞中的表达受β-连环蛋白信号通路TCF4调控。
4、KLRK1 (NKG2D)和ULBP1在肝癌中的表达与免疫细胞标志物相关。
5、在CTNNB1突变的肝癌中NKG2D配体的低水平表达可能是这些肿瘤炎性较轻、侵袭性较低的原因。
主要结果
NKG2D配体MICA和MICB在人类HCC中的表达与肿瘤侵袭性和患者不良预后相关
我们通过RT-qPCR分析评估了354例患者样本中MICA和MICB表达与肝癌特定临床特征之间可能的联系。我们首先通过诊断确定了这些基因的表达水平,如下:早期肝癌 (N=10),肝癌起源于肝细胞腺瘤 (HCC对HCA;N=7)和肝癌 (N=337),以正常肝脏 (NL)样本 (N=5)作为对照 (图1A)。我们发现MICA和MICB在早期肝癌和肝癌/肝细胞腺瘤中的表达明显强于正常肝脏 (N=5)。此外,MICA和MICB在肝癌中比早期肝癌和肝细胞腺瘤上的HCC表达更强 (图1A)。我们还检测了MICA和MICB的表达水平是否呈正相关 (R=0.677,p<0.0001),表明这两个位于6号染色体hla类区域的基因在肝肿瘤发生过程中是共同诱导的。然后,我们根据edmondson-steiner分级标准评估了< span="">肝癌 MICA和MICB的表达,以区分了四种特定的肝癌分期,并描述了肿瘤细胞分化。我们发现MICA和MICB的表达与肿瘤分级和低分化水平呈正相关 (图1B)。已知这些配体主要在转录水平上受到调控。
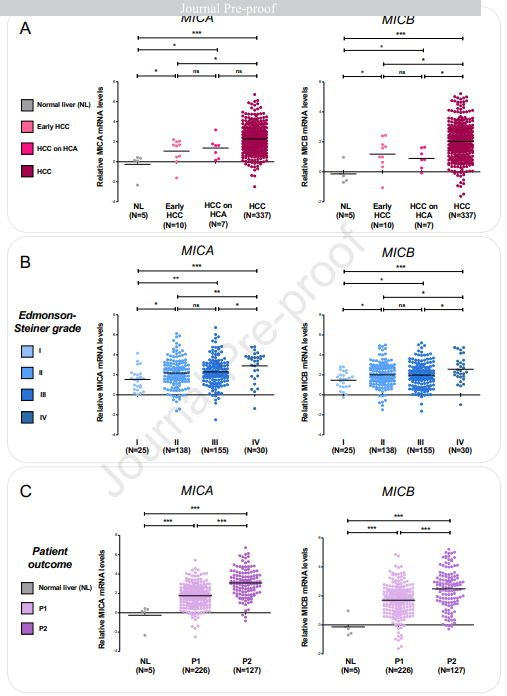
图1. MICA和MICB表达在人类肝癌发展过程中上调,且与肿瘤分级密切相关
NKG2D配体MICA和MICB在表现出染色体稳定性的HCC中表达较弱
通过评估MICA和MICB表达作为人类肝癌分子分类的功能,我们研究了MICA/B的表达是否与特定的遗传改变相关。该分类分为三组,即G1至G3组 (以具有高度染色体不稳定性和TP53突变的侵袭性HCC肿瘤为特征)和G4至G6组 (它们与更好的预后、染色体稳定性和分化良好的肿瘤表型相关)。CTNNB1突变的HCC属于G5-G6组,无炎性浸润。我们发现,在G4至G6组的HCC样本中,MICA和MICB的表达水平均显著低于G1至G3组的样本 (图2A)。
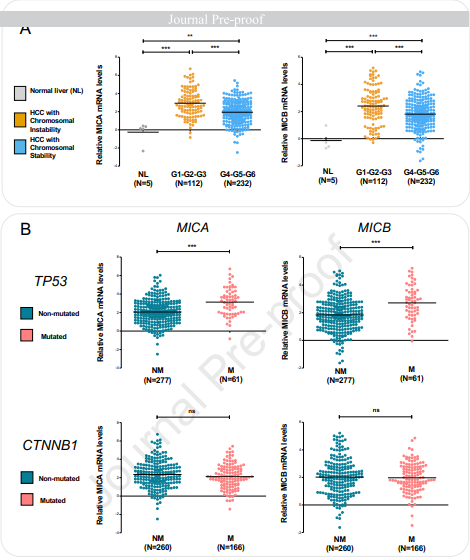
图2. MICA和MICB的表达在G1/G2/G3 HCC组中显著上调,在染色体稳定性良好的G4/G5/G6 HCC组中表达较弱
小鼠中CTNNB1突变的HCC具有低水平的NKG2D配体表达
我们研究了调节NKG2D配体在两种小鼠肝肿瘤发生模型中表达的分子机制,再现了两种主要人类肝癌的特征。二乙基亚硝胺 (DEN)诱导的肝癌模型模拟显示优先Ras突变和无Ctnnb1激活突变的侵袭性不稳定肿瘤,而Lpk-myc+模型模拟具有Ctnnb1突变和稳定染色体的HCC肿瘤。我们评估了这些模型中NKG2D配体的表达水平。与人类数据一致,我们发现相对于无肿瘤的对照组肝脏,在侵袭性HCC中小鼠NKG2D配体 (Rae-1δ,Rae-1ε,人类ULBP直系同源物)的mRNA水平显著上调 (图4A)。然而,在人类肝癌中,这些配体的表达在有Ctnnb1突变的HCC中被显著下调,这表明β-连环蛋白信号在这种下调中发挥了作用 (图4A)。
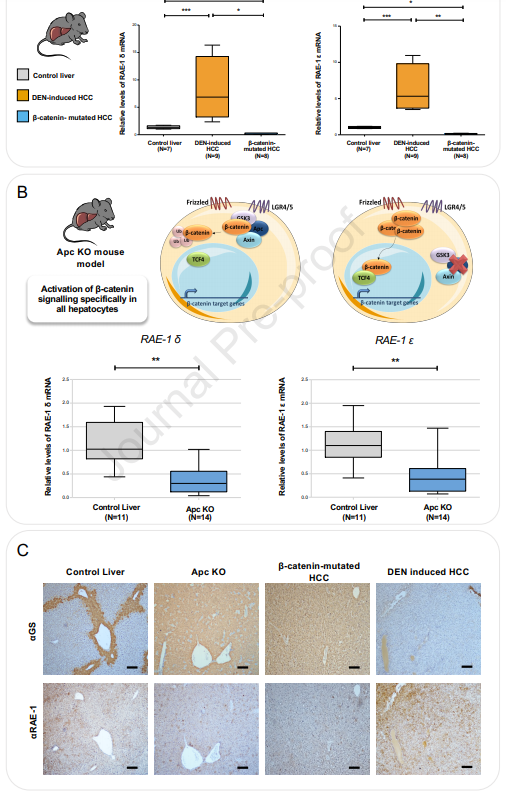
图4. 在显示β-连环蛋白激活的肝癌中,Rae-1 δ和Rae-1ε NKG2D配体的表达被显著下调
NKG2D受体和ULBP1的表达与HCC炎性细胞的存在有关
鉴于NKG2D配体在侵袭性炎症肝癌中上调,而在炎症水平较低的CTNNB1突变的肝癌中ULBP1/2表达下调,我们研究了NKG2D系统与人类炎症状态之间是否存在关系,如最近在小鼠中报告的那样。我们监测了肝癌患者队列中KLRK1 (NKG2D受体)的表达。我们发现KLRK1在显示淋巴细胞炎症的肝癌样本中表达更强 (图6A)。此外,使用MCP对抗分析来确定肿瘤微环境内炎性浸润的性质,我们发现KLRK1表达与内皮细胞和免疫群体特征 (B细胞、T细胞、细胞毒性细胞、髓样树突状细胞、中性粒细胞和NK细胞)之间有很强的相关性。我们还发现,除NK细胞外,ULBP1表达与这些免疫群体之间存在弱相关。
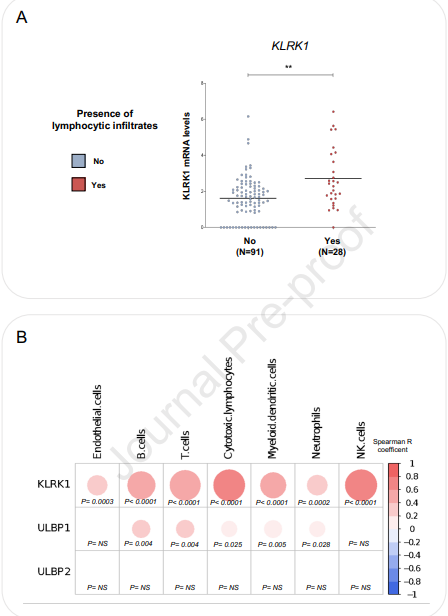
图6. NKG2D受体和ULBP1的表达与HCC炎性细胞的存在有关
结论及展望
NKG2D系统是一种有效的癌症免疫监测机制。关于NKG2D配体在肝癌中表达的研究较少。本研究发现,在大量的肝癌患者和肝癌专用小鼠模型中,NKG2D配体的表达与侵袭性肿瘤发生相关,而在CTNNB1突变的肝癌中下调。本研究还证明了NKG2D配体的表达与侵袭性肝肿瘤的发生相关,并且通过β-catenin信号通路下调,这些配体可能成为CTNNB1突变的HCC肿瘤侵袭性较低的原因。
原文链接
https://www.journal-of-hepatology.eu/article/S0168-8278(21)00028-3/fulltext
参考文献
1.Cadoux Mathilde,Caruso Stefano,Pham Sandrine et al. Expression of NKG2D ligands is downregulated by beta-catenin signaling and associates with HCC aggressiveness.[J] .J Hepatol, 2021, undefined: undefined.













